Удивительно, но долгое время эта деталь не привлекала особого внимания со стороны научного сообщества:
Вымирание динозавров и многих других групп животных на границе мелового и палеогенового периодов было последним из шести крупных эпизодов массового вымирания, идентифицированных около 1960 года на основе летописи окаменелостей; предыдущие вымирания (в хронологическом порядке) произошли около или в конце кембрийского, ордовикского, девонского, пермского и триасового периодов. Однако очень немногие биологи-эволюционисты или палеонтологи (исследователи окаменелостей) видели какие-либо основания полагать, что этим событиям требовалось особое объяснение. К этому времени синтетическая теория эволюции, сочетающая традиционный дарвинизм с популяционной генетикой, стал преобладающей эволюционной парадигмой, и считалось, что весь ход жизни на Земле можно объяснить с помощью механизма адаптивной мутации. [1]Дарвинисты в порядке рабочей гипотезы объясняют эволюционные скачки освобождением экологических ниш, что позволяет появляться новым видам. Этот теоретический процесс называется адаптивной радиацией[2]. Согласно ему освобождение от конкуренции, вызванное массовым вымиранием, позволяет совершать последующие эволюционные скачки.
Если снижение конкуренции действительно было движущей силой эволюционных скачков, то чем более серьёзным было массовое вымирание, тем ниже становилась конкуренция и, следовательно, тем большим должен быть эволюционный скачок. Однако это совсем не так:
Нет очевидной связи между масштабами вымирания и его экологическими или эволюционными последствиями.[3].На самом деле данные палеонтологов показывают, что конкуренция или её отсутствие не играют никакой роли в возникновении новых видов или исчезновении существующих:
Летопись окаменелостей на глубоководье показывает, что возникновение и исчезновение видов — это отдельные события, не связанные с другими видами в той же среде. Конкурентная замена (более приспособленный вид, выходящий из периферийной среды и вытесняющий устоявшийся вид), как правило, не наблюдается.[4]Бактерию можно оставить в любой среде сколь угодно долго; есть конкуренция или нет, это не приведёт к появлению трилобита. Этот момент дополнительно иллюстрируется ранее упомянутой смехотворно низкой вероятностью[5] появления даже простейшей клетки. Свободное экологическое пространство не может объяснить внезапное появление новых и более сложных видов, которые, по крайней мере в некоторых случаях, лишены каких-либо известных предков. Хотя в некоторых случаях конкурентная замена может играть незначительную роль, этого недостаточно, чего-то явно не хватает.
Согласно недавним исследованиям, массовые вымирания действительно способствуют последующим эволюционным скачкам:
Нельзя отрицать глубокий эволюционный импульс, который массовые вымирания придали истории жизни. Массовые вымирания создают новые эволюционные возможности и перенаправляют ход эволюции. [6]Но как массовые вымирания (акт разрушения) могут привести к взрыву жизни (акт созидания), если не через дарвиновскую конкурентную замену? По мнению английского биохимика и эволюциониста Тревора Палмера, ответ кроется в генетике:
Достижения в области генетики показали, что массовые вымирания могут сделать больше, чем просто создать свободное экологическое пространство для распространения новых видов. Кажется очевидным, что стресс может привести к гипермутациям, а также к эпигенетическим изменениям, поэтому следует считать возможным, что катастрофический эпизод массового вымирания может привести к появлению целого ряда вариантов, выходящих за рамки того, что могло произойти в обычное время[7].Что может быть причиной вышеупомянутых "гипермутаций" и "эпигенетических изменений", которые приводят к появлению новых видов?
Кстати, эволюционные скачки, наблюдаемые после массовых вымираний, требуют не просто "гипермутаций", как указано в приведённой выше цитате, а полезных гипермутаций, позволяющих внезапно появляться не только новым, но и более сложным, более организованным формам жизни. Что может вызвать эти фундаментальные и благотворные изменения?
Появление новых и более сложных видов после массовых вымираний, вызванных кометами, — это повторяющаяся закономерность. Такое появление новых видов называется "видообразованием". Этот процесс наблюдался в реальном времени лишь единожды у животных[8], а именно у австралийских скальных валлаби.
В настоящее время реорганизация ретровирусов в их геномах приводит к рождению нового вида:
В 2001 году О'Нил и её коллеги показали, как ретровирусы, обитающие в центромерах хромосом гибридных австралийских скальных валлаби, создают новые виды путём массового манипулирования фрагментами хромосом. [9]Эта гипотеза вирусного видообразования, раскрытая в приведённой выше цитате, согласуется с тезисом Тревора Палмера, согласно которому видообразование происходит благодаря "гипермутации" и "изменениям эпигенетики". Действительно, известно, что вирусы играют важную роль в эпигенетике:
Считается, что вирусы, заражающие клетки животных, играют центральную роль в формировании эпигенетического сценария инфицированных клеток. В этом контексте стало очевидно, что знание того, какое влияние оказывают вирусные инфекции на эпигенетический контроль клеток-хозяев, несомненно, приведёт к лучшему пониманию взаимодействия вирусов с клетками животных[10].Аналогичным образом вирусы являются основной причиной "гипермутаций" в геномах хозяев, используя, по крайней мере, три различных процесса:
1/ Интеграция вирусного генома в геном хозяина. Эта интеграция является необходимым шагом[11] для всех ретровирусов. Она также происходит и для других вирусов, включая такие распространённые, как гепатит Б[12], герпес-вирус человека[13] (HHV-6) или вирус Эпштейна — Барр[14].
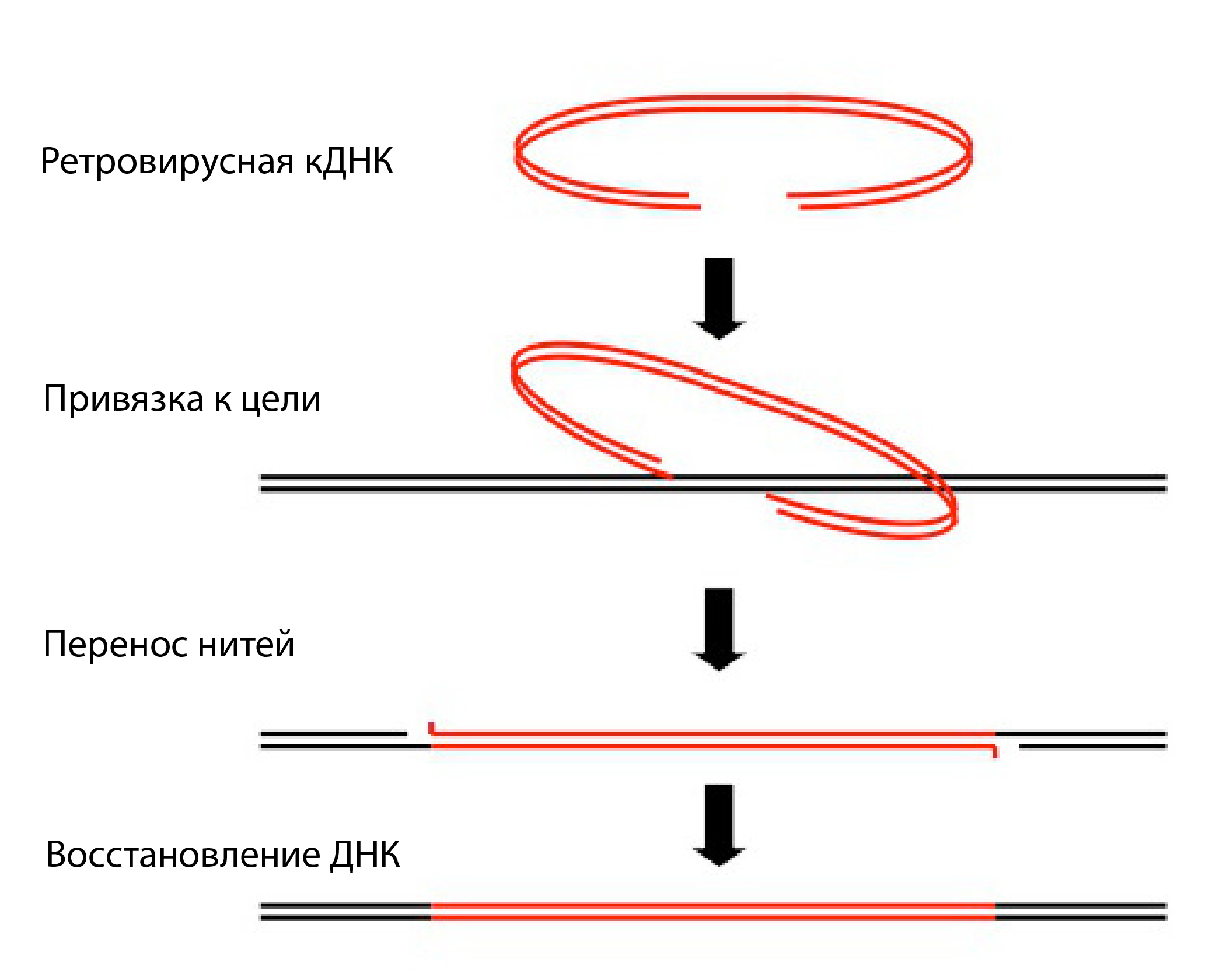
Давайте проиллюстрируем интеграцию вирусного генома на примере. Некое животное подвергается воздействию нового вируса, переносимого по воздуху, воде или другими живыми организмами. В данный момент времени для этого животного вирус является экзогенным. Если вирусная инфекция и интеграция произойдёт в зародышевой линии этого хозяина, эта последовательность вируса станет частью ДНК его потомков — экзогенный вирус стал эндогенным, и с этого момента это наследственная вирусная последовательность, интегрированная в геномы потомков хозяина. Эта интеграция вирусных генетических последовательностей в ДНК хозяина изменяет фактически её, как показано на следующей иллюстрации:
2/ После интеграции вируса он может и далее изменять геном хозяина посредством ряда модификаций: дупликации[15], делеции[16], репликации[17] и очагов рекомбинации[18].
3/ Вирусные последовательности, внедрённые в геном хозяина, изменяют экспрессию этого генома. Другими словами, они включают и выключают существующие гены[19] генома хозяина. Этот момент будет рассмотрен далее.
На самом деле, вызванные вирусом модификации генома хозяина настолько глубоки, что могут привести к принципиально противоположным результатам: смерти, с одной стороны, эволюции — с другой, в зависимости от хозяина. Эта двойственность напоминает повторяющиеся сценарии массовых вымираний, когда устаревшим видам грозит гибель, в то время как сохранившиеся эволюционируют:
При заражении клеток некоторые вирусы интегрируют свой геном в хромосому хозяина либо как часть своего жизненного цикла (например, ретровирусы), либо случайно. Хотя интеграция вирусного генома может способствовать длительной персистенции вируса в клетке, она также может привести к серьёзным последствиям для клетки-хозяина, включая нарушение работы генов, инсерционный мутагенез и гибель клеток, а также способствовать эволюции видов[20].Продолжающееся видообразование среди валлаби — не единственный случай появления новых форм жизни, вызванных вирусными последовательностями. Само появление человеческого рода также связано с вирусной активностью:
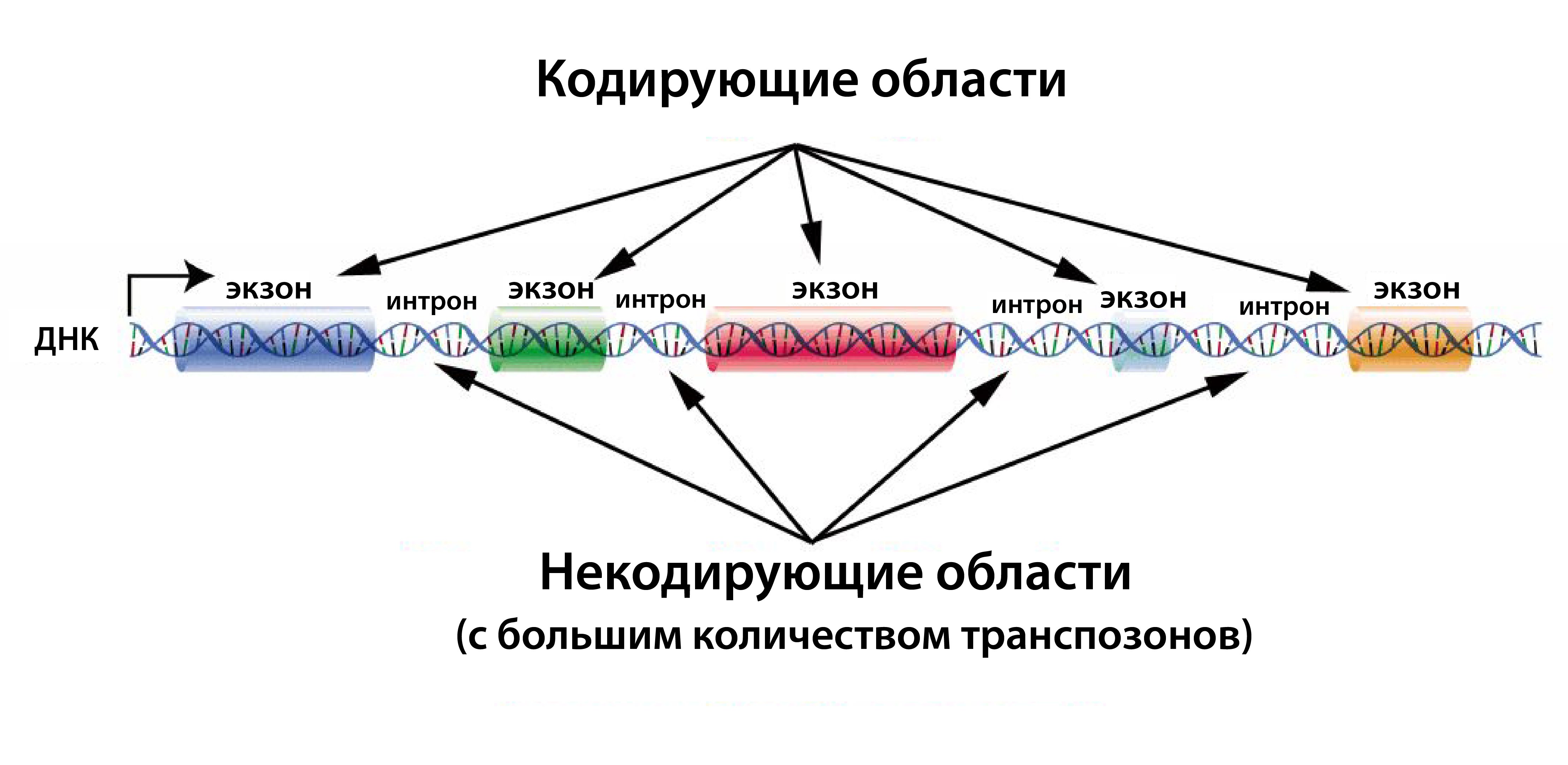
Люди разделяют около 99% своей геномной ДНК с шимпанзе и бонобо; таким образом, различия между этими видами вряд ли заключаются в содержании генов, но могут быть вызваны унаследованными изменениями в регуляторных системах. Эндогенные ретровирусы (ЭРВ) составляют около 5% генома человека. Длинные концевые повторы ЭРВ содержат множество регуляторных последовательностей, таких как промоторы, энхансеры, сигналы полиаденилирования и сайты связывания факторов. Таким образом, они могут влиять на экспрессию близлежащих человеческих генов. [...] Вполне вероятно, что некоторые из этих ЭРВ могли интегрироваться в регуляторные области человеческого генома и, следовательно, могли оказать влияние на экспрессию соседних генов, которые, соответственно, внесли свой вклад в эволюцию человека[21].В приведённой выше цитате автор проводит различие между кодирующими генами (т. е. создающими белки) и некодирующими генами, которые не создают белки, а регулируют активность кодирующих областей.
Если использовать аналогию, кодирующие гены подобны музыкантам, которые вместо того, чтобы производить звук, создают белки, являющиеся фундаментальными строительными блоками форм жизни. Некодирующие гены играют ещё более фундаментальную роль; они подобны дирижёру оркестра, который вместо того, чтобы направлять музыкантов, направляет[22] экспрессию кодирующих генов.
Как показано на иллюстрации выше, случайно или нет, большинство вирусных последовательностей интегрированы[23] в наши некодирующие гены, в то время как они очень редки в кодирующих областях[24].
Теперь, когда мы знаем немного больше о кодирующих и некодирующих областях, давайте вернёмся к появлению людей и проясним причину, по которой вирусы являются вероятной причиной расхождения между людьми и другими гоминидами (человекообразными обезьянами).
— Разница в геноме между человеком и шимпанзе составляет всего 0,5% в активных кодирующих областях[25]. Таким образом, морфологические (также известные как фенотипические) различия должны исходить из некодирующих областей.
— В некодирующих областях (директорах оркестра) наиболее активные[26] последовательности ДНК называются ДКП (длинные концевые повторы) и имеют вирусное происхождение[27].
— Из 19 ДКП, присутствующих в геномах человека и других человекообразных обезьян, 17 (~90%) были специфичны для человека[28].
Три вышеизложенных пункта показывают, что основное генетическое различие между людьми и шимпанзе заключается в вирусных ДКП, которые, таким образом, являются вероятной генетической причиной очевидных морфологических различий.
Обратите внимание, что влияние вирусов на геном человека и его экспрессию не прекратилось с расхождением между людьми и другими человекообразными обезьянами. С тех пор вирусы заметно изменили человеческую ДНК:
Поразительные 30 процентов всех белковых адаптаций с момента расхождения людей с шимпанзе были вызваны вирусами[29].Не только вирусы считаются причиной появления человеческого рода, но и появление целого таксономического семейства (гоминиды), к которому он принадлежит вместе с семью другими сохранившимися видами человекообразных обезьян[30], также приписывается вирусам:
Хьюз и Коффин использовали филогенетический анализ и анализ последовательностей, чтобы сделать предположение, что эндогенные ретровирусы человека могли вызвать крупномасштабные делеции, дупликации и перестановки хромосом в геномной эволюции человека. По мнению генетика Евгения Свердлова, эти вирусы сыграли значительную роль в эволюции и дивергенции гоминидов[31].Одним из предоставленных Свердловым доказательств корреляции дивергенции гоминидов с активностью ретровирусов, является заметное появление ретровирусов в геномах хозяев в то время, когда человекообразные обезьяны (гоминиды) отличались от других обезьян:
Некоторые эндогенные ретровирусы человека появились в геноме более 30 млн лет назад, в то время как другие появились сравнительно недавно, примерно во время расхождения линий гоминидов и обезьян[32] [33].Появление плацентарных млекопитающих, к которым принадлежит семейство гоминидов, также связано с геномной интеграцией вирусных последовательностей[34].
Случайно или нет, но самая ранняя окаменелость плацентарного млекопитающего датируется 66 млн лет назад, как раз во время мел-палеогенового вымирания. Эта окаменелость принадлежит к виду Protungulatum donnae[35].
Таксономический подкласс плацентарные млекопитающие является наиболее представленным из трёх подклассов млекопитающих и насчитывает почти 4000 видов[36], отличающихся широким морфологическим разнообразием: от летучей мыши до кита.
До появления плацентарных репродуктивные стратегии основывались на откладывании яиц. Плацентарные принесли с собой ряд крупных инноваций: плаценту и матку, конечно, но также деактивацию иммунной системы матери против плода и защиту его от инфекций, так как он практически лишён какого-либо иммунитета. Эндогенные ретровирусы играют важную роль в этих инновациях:
— Они необходимы для морфогенеза плаценты[37].
— Они защищают плод от инфекций, вызываемых родственными экзогенными ретровирусами[38].
— Они защищают плод от иммунной системы матери[39].
— Они контролируют экспрессию генома эмбриона во время его развития[40].
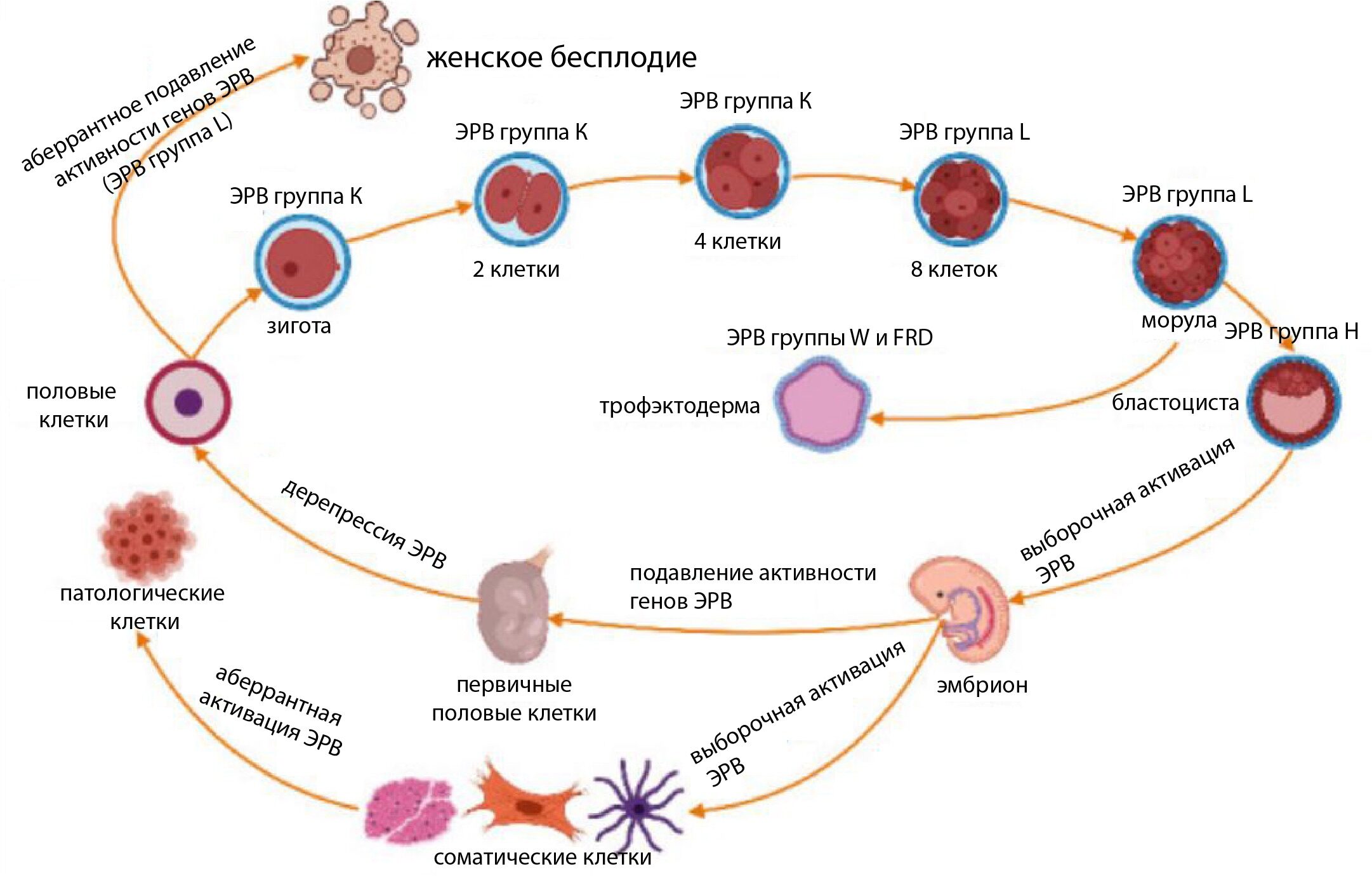
На иллюстрации ниже показана роль, которую играют некоторые эндогенные ретровирусы на каждом этапе развития от зародышевой клетки до полностью сформированного эмбриона. Следует помнить, что ещё не все эндогенные ретровирусы у плацентарных были идентифицированы и ещё меньше их было описано. Несмотря на эти ограничения, роль, которую играют эндогенные ретровирусы, можно назвать всепроникающей:
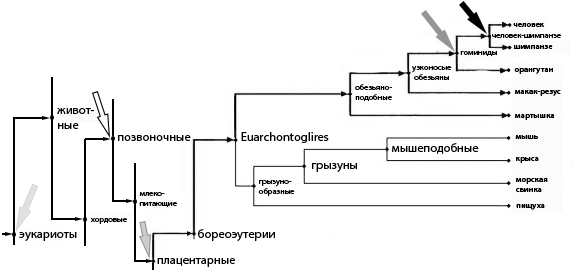
Таксономический подкласс плацентарных млекопитающих (Eutheria) относится к таксономической подгруппе позвоночных, которая появилась во время ранее описанного кембрийского взрыва[41] и совпадает как филогенетически[42], так и во времени с появлением ретровирусов вместе с их позвоночными хозяевами:
Недавние исследования датируют появление сложных ретровирусов линий позвоночных во время или непосредственно перед кембрийским взрывом около 500 млн лет назад. Известно, что такие вирусы, вероятно, связаны с основными эволюционными геномными процессами[43].Если пойти дальше по филогенетическому древу, ведущему к людям, можно вновь обнаружить выдающуюся роль эндогенных ретровирусов на этот раз в создании клеточного ядра[44] и появлении одного из трёх[45] доменов жизни — эукариотов[46] (организмы, клетки которых имеют ядро), — охватывающего практически все макроскопические формы жизни, включая ранее описанных позвоночных.
Итак, появление рода людей, вышележащего семейства (гоминиды), вышележащего подкласса (плацентарные), вышележащего подтипа (позвоночные) и домена (эукариоты) тесно связано с интеграцией эндогенных ретровирусов в геномы хозяев.
На схеме ниже, слева направо, светло-серой стрелкой показано появление эукариотов, белой — дивергенция позвоночных от других хордовых[47], стрелкой серого цвета — дивергенция плацентарных, тёмно-серой — дивергенция высших приматов (гоминидов), а чёрной — дивергенция человека:
Для дальнейшей иллюстрации фундаментальной роли, которую играют вирусы в видообразовании, показателен пример синцитина. Синцитин — это белок, кодируемый эндогенным ретровирусом человека под названием HERW1 и участвующий в сложном развитии плацентарных млекопитающих, описанном ранее. Роль синцитина настолько кардинальна, что он необходим для развития плаценты:
Генетические исследования на мышах показали, что белки, кодируемые синцитином A (Syna) и Synb, которые возникли независимо в линии грызунов из разных копий эндогенных ретровирусов, необходимы для формирования двухслойного синцитиотрофобласта мышиной плаценты[48].Неожиданная особенность синцитина заключается в том, что он был приобретён млекопитающими по меньшей мере семь раз во время отчётливой интеграции различных вирусов, и каждый раз эта интеграция коррелирует с последовавшими событиями видообразования:
Приобретение синцитина от различных вирусов происходило независимо по меньшей мере семь раз, причём каждое событие происходило после дивергенции отрядов млекопитающих, в которых они обнаружены[49].Кроме того, палеовирологические анализы установили, что синцитин-1, обнаруженный у человека, возраст которого составляет около 30 млн лет[50], совпадает с вымиранием в конце эоцена.
Парадокс, связанный с тем, что практически идентичные геномы приводят к разной морфологии, не ограничивается вышеупомянутым примером человек/шимпанзе. На самом деле, по сравнению друг с другом, большинство форм жизни демонстрируют одно и то же противоречие. Это болезненный вопрос для дарвинистов, согласно которым эволюция протекает через постепенные генетические изменения, приводящие к постепенным морфологическим изменениям. Очевидно, что это не так:
Результаты недавних исследований в области эволюционной биологии развития показывают, что разнообразие строения тела и морфологии организмов многих типов необязательно отражается в разнообразии на уровне последовательностей генов, включая последовательности генетического инструментария развития и других генов, участвующих в развитии. Действительно, как отметили Джон Герхарт и Марк Киршнер, существует очевидный парадокс: "там, где мы больше всего ожидаем найти вариации, мы обнаруживаем сохранение, отсутствие изменений". Итак, если наблюдаемая морфологическая новизна между различными кладами не обусловлена изменениями в последовательностях генов (например, в результате мутации), то откуда она берётся? Новизна может возникнуть в результате мутационных изменений в регуляции генов[51].Как подробно описано на примере дивергенции человек-шимпанзе и применимо практически к любым формам жизни, вирусные последовательности могут вызывать и вызывают различную экспрессию практически идентичных геномов[52], что разрешает парадокс из цитаты выше.
Существует огромное количество[53] вирусов, интегрированных в геномы различных хозяев, но их интеграция систематически не датируется. Тем не менее изучение научной литературы позволяет выявить четыре даты интеграции трёх различных семейств вирусов в геномы млекопитающих:
— интеграция борнавирусов около 93 млн лет назад;
— интеграция цирковирусов около 68 млн лет назад;
— интеграция филовирусов и парвовирусов 30 млн лет назад.
Обратите внимание, что каждая из этих четырёх датировок почти идеально соответствует времени некоторых из последних массовых вымираний:
— позднеэоценовое вымирание около 34 млн лет назад (кометный цикл #2);
— мел-палеогеновое вымирание около 66 млн лет назад (кометный цикл #3);
— cеномано-туронское вымирание около 93 млн лет назад (кометный цикл #4).
Кроме того, появление новых семейств вирусов, по-видимому, также связано со временем массовых вымираний, вызванных кометами. Это, например, касается семейства бакуловирусов, содержащего 85 видов вирусов[54], в основном заражающих насекомых[55]. Считается, что бакуловирусы появились около 310 млн лет назад[56], то есть во время каменноугольно-пермского вымирания.
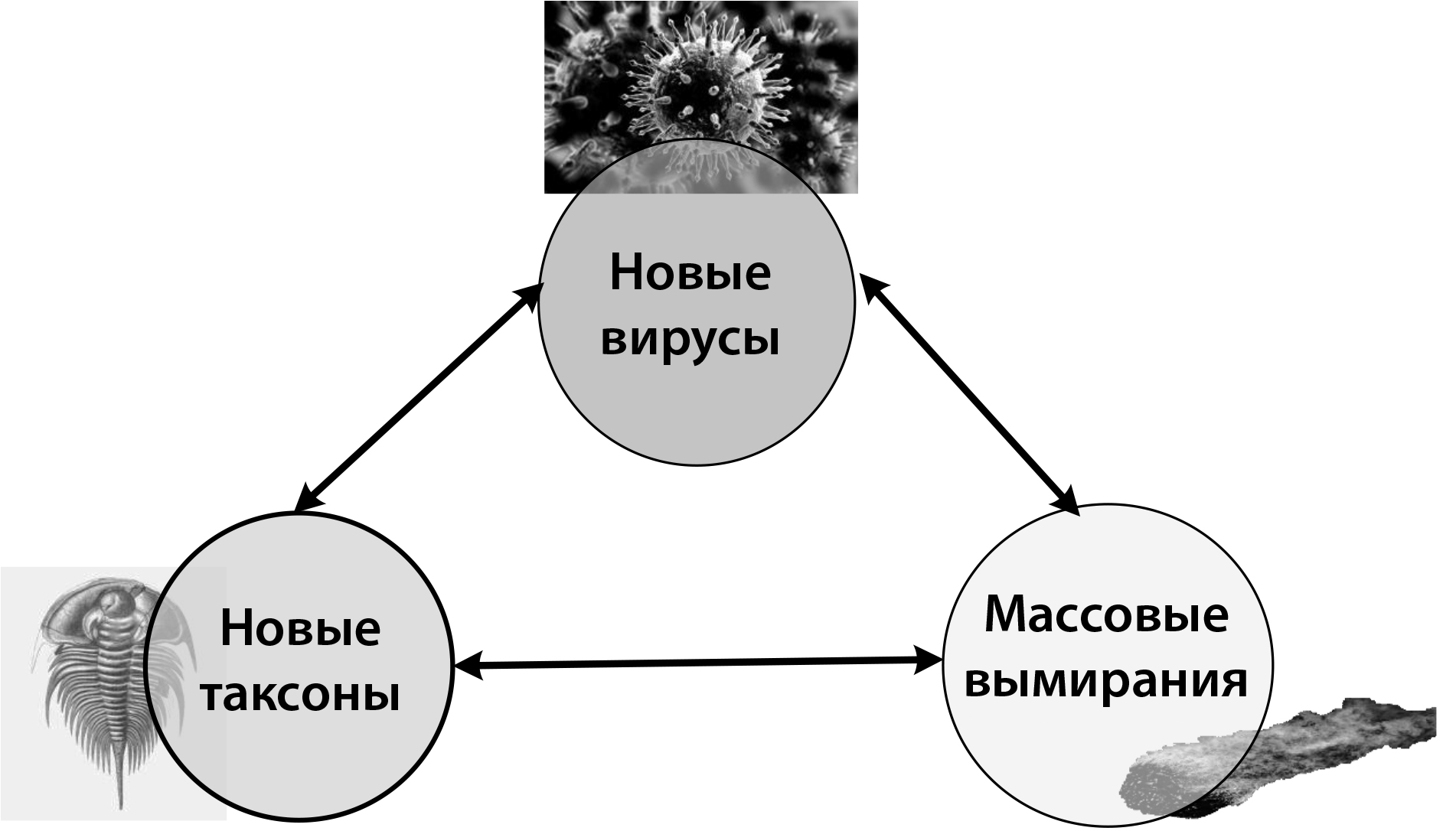
В этой главе мы наблюдали три сильные корреляции:
1/ Эндогенные ретровирусы и новые таксоны: эндогенные ретровирусы связаны с появлением целых новых таксонов; видов, как, например, людей или валлаби; семейств (гоминиды); подсемейств (позвоночные) и даже таксономического домена (эукариоты).
2/ эндогенные ретровирусы и массовые вымирания: интеграция новых вирусных семейств (борнавирусы, цирковирусы, филовирусы и бакуловирусы) и новых вирусов (вирусный ген синцитин-1) в геномы хозяев ассоциируется со временем массовых вымираний.
3/ Новые таксоны и массовые вымирания: появление ряда новых таксонов неоднократно связывалось с массовыми вымираниями, как подробно описано в части II.
Являются ли эти три корреляции случайными или же массовые вымирания, вызванные кометами, отмечают время, когда новые эндогенные ретровирусы интегрируются в геномы хозяев, и время, когда эти геномные интеграции приводят к появлению новых форм жизни?
Мы уже видели два примера, когда эти три корреляции были частью единой последовательной цепочки событий: а) дивергенция плацентарных благодаря геномной интеграции нового вируса во время мел-палеогенового вымирания, б) появление новых вирусов вместе с их позвоночными хозяевами во время кембрийского взрыва жизни.
Но примеры плацентарных и позвоночных нельзя назвать странными исключениями. В научной литературе известны и другие случаи, когда интеграция новых эндогенных ретровирусов способствовала появлению новых видов во время массового вымирания или вскоре после него:
— Челюстные позвоночные появились после ордовикско-силурийского вымирания. Анализ их геномов показал вирусное происхождение белков RAG1 и RAG2, а также их ключевую роль в видообразовании челюстных позвоночных:
Результаты подтверждают теорию о том, что RAG1 и RAG2 когда-то были компонентами транспозонов [вирусного происхождения[57]], и что расщепление генов иммуноглобулинов и Т-клеточных рецепторов происходит от встраивания этого элемента в прежний ген рецептора вскоре после эволюционной дивергенции челюстных и бесчелюстных позвоночных[58].— Костистые рыбы появились после массового пермского вымирания, и их появление было, по крайней мере частично, вызвано вирусными последовательностями:
В отличие от геномов млекопитающих, геномы костистых рыб также содержат множество семейств активных транспозонов [вирусного происхождения[59]], которые могли сыграть определённую роль в видообразовании, влияя на стерильность и жизнеспособность гибридов[60].— Чешуекрылые: целый отряд насекомых, включающий 126 семейств[61] и 180 000 видов, включая мотыльков, ос и бабочек. Чешуекрылые представляют 10% видов живых организмов[62] и появились 200 млн лет назад[63] во время массового пермского вымирания без однозначно идентифицированных предков[64]. В то же время[65] появилось новое семейство вирусов — браковирусы, которые симбиотически обитают практически во всех видах чешуекрылых[66].
[1] Palmer, Trevor (2018) "Perilous Planet Earth Revisited Chronology and Catastrophism" ResearchGate.
[2] Givnish, T.J. (2015) "Adaptive radiation versus 'radiation' and 'explosive diversification': why conceptual distinctions are fundamental to understanding evolution" New Phytol, 207: 297-30
[3] Douglas H. Erwin (2001) "Lessons from the past: Biotic recoveries from mass extinctions". PNAS, 98 (10) 5399-5403
[4] Cesare Emiliani (1994). "Evolution--a composite model" Evolutionary Theory, Vol.10, No.6, 299-303
[5] ~1040 000
[6] Erwin, Douglas (2001) "Lessons from the past: Biotic recoveries from mass extinctions" PNAS 98 (10) 5399-5403
[7] Trevor Palmer (2010) "Lamarck - The Man, the Myth and the Legacy". C&C Review, pp. 40-51
[8] Часто упоминаются два других случая видообразования в реальном времени: 1. центральноевропейская чёрноголовка — птица, которая "возможно, находится на грани видообразования". 2. галапагосский вьюрок, анализ генома которого показал, что, в конце концов, это был всего лишь большой кактусовый земляной вьюрок.
См.: Jennifer Skene (2010) "Evo in the news: Speciation in real time" UC museum of Paleontology
University of Berkeley contributors (2010) "Understanding Evolution: Speciation in real time" University of Berkeley
[9] Райан, Фрэнк. (2004). "Human endogenous retroviruses in health and disease: a symbiotic perspective". Journal of the Royal Society of Medicine, 97(12), 560 - 565.
[10] Silvia C. Galvan et al. (2015)."Epigenetics and animal virus infections". Editorial. Frontiers in Genetics.
[11] Desfarges, S., Ciuffi, A. (2012) "Viral Integration and Consequences on Host Gene Expression" Viruses: Essential Agents of Life, 147 - 175
[12] Murakami Y et al. (2005) "Large scaled analysis of hepatitis B virus (HBV) DNA integration in HBV related hepatocellular carcinomas" Gut 54:1162-1168
[13] Pellett PE et al (2011) "Chromosomally integrated human herpesvirus 6: questions and answers". Rev Med Virol
[14] Gao J, et al. (2006) "Epstein-Barr virus integrates frequently into chromosome 4q, 2q, 1q and 7q of burkitt's lymphoma cell line" J. Virol. Methods 136:193-199
[15] Hughes JF, Coffin JM (2001) "Evidence for genomic rearrangements mediated by human endogenous retroviruses during primate evolution" Nature Genetics. 29 (4): 487 - 89
[16] Campbell, I. et al. (2014) "Human endogenous retroviral elements promote genome instability via non-allelic homologous recombination" BMC biology, 12, 74
[17] Там же.
[18] Mighel, A.J. et al (1997). "Alu sequences" FEBS Lettre 417, 1 - 5
[19] Ген — это последовательность ДНК или РНК.
[20] Desfarges, S. et al. (2012) "Viral Integration and Consequences on Host Gene Expression". Viruses: Essential Agents of Life, 147 - 175
[21] Khodosevich, K. et al. (2002). "Endogenous retroviruses and human evolution." Comparative and functional genomics, 3(6), 494 - 498
[22] Fernandes, J. et al. (2019) "Long Non-Coding RNAs in the Regulation of Gene Expression: Physiology and Disease". Non-coding RNA, 5(1), 17
[23] De Parseval, N. et al. (2003) "Survey of human genes of retroviral origin: identification and transcriptome of the genes with coding capacity for complete envelope proteins" Journal of virology, 77(19), 10414 - 10422
[24] De Parseval, 2003
[25] Goodman M. (1999) "The genomic record of humankind's evolutionary roots". Am J Hum Genet 64: 31 - 39
[26] Boeke JD, Stoye JP. (1997). ''Retrotransposons, endogenous retroviruses, and the evolution of retroelements" In Retro- viruses, Cold Spring Harbor Laboratory Press 343 - 435
[27] Lower R, et al. (1996) "The viruses in all of us: characteristics and biological significance of human endogenous retrovirus sequences" PNAS 93:5177 - 5184
[28] Khodosevich, K. et al. (2002) "Endogenous retroviruses and human evolution." Comparative and functional genomics, 3(6), 494 - 498
[29] Genetics Society of America (2016) "Viruses revealed to be a major driver of human evolution: Study tracking protein adaptation over millions of years yields insights relevant to fighting today's viruses" ScienceDaily
[30] 3 вида орангутана, 2 вида горилл, 1 вид шимпанзе и 1 вид бонобо. См.:
Groves, C. P. (2005) "Mammal Species of the World: A Taxonomic and Geographic Reference (3rd ed.)" Johns Hopkins University Press. pp. 181 - 184
[31] Ryan, Frank (2004) "Human endogenous retroviruses in health and disease: a symbiotic perspective". Journal of the Royal Society of Medicine, 97(12), 560 - 565
[32] Sverdlov ED. (2000) "Retroviruses and primate evolution" Bioessays;22(2):161-71
[33] Некоторые из эндогенных ретровирусов, которые отличают человекообразных обезьян от других приматов, — это Fc2master и Fc2 env.
[34] Chuong E. B. (2013) "Retroviruses facilitate the rapid evolution of the mammalian placenta" BioEssays : news and reviews in molecular, cellular and developmental biology, 35(10), 853 - 861
[35] O'Leary et al. (2013) "The Placental Mammal Ancestor and the Post - K-Pg Radiation of Placentals" Science. 339 (6120): 662 - 667
[36] Dave Smith (1994) "Eutheria, the Placental Mammals" University of Berkeley Museum of Paleontology
[37] Mi, S. (2000) "Syncytin is a captive retroviral envelope protein involved in human placental morphogenesis." Nature 403:785 - 788
[38] Benit, L. (2001). "Identification, phylogeny, and evolution of retroviral elements based on their envelope genes." J. Virol. 75:11709 - 11719
[39] Cianciolo, G. J. et al. (1985). "Inhibition of lymphocyte proliferation by a synthetic peptide homologous to retroviral envelope protein''. Science 230:453 - 455
[40] Fu, B., et al. (2019). "Endogenous Retroviruses Function as Gene Expression Regulatory Elements During Mammalian Pre-implantation Embryo Development". International journal of molecular sciences, 20(3), 790
[41] См. часть II: Глава "Кембрийский взрыв".
[42] Aiewsakun, P. et al. (2017) "Marine origin of retroviruses in the early Palaeozoic Era" Nature Communications 8, 13954
[43] Edward J. Steele, et al. (2018). "Cause of Cambrian Explosion - Terrestrial or Cosmic?" Progress in Biophysics and Molecular Biology, Volume 136, Pages 3-23
[44] Takemura M (2001) "Poxviruses and the origin of the eukaryotic nucleus". Journal of Molecular Evolution. 52 (5): 419 - 425
[45] Два других домена — это прокариоты (бактерии) и археи (одноклеточные организмы).
[46] Yoshikawa G et al. (2019) "Medusavirus, a Novel Large DNA Virus Discovered from Hot Spring Water" Journal of Virology. 93 (8)
[47] Таксономический тип, включающий все формы жизни, имеющие позвоночник наряду с другими отличительными признаками.
[48] Feschotte, C., Gilbert, C. (2012) "Endogenous viruses: insights into viral evolution and impact on host biology" Nature Review Genetics 13, 283 - 296
[49] Katzourakis A. (2013) "Paleovirology: inferring viral evolution from host genome sequence data" Philosophical transactions of the Royal Society of London. 368(1626), 20120493
[50] Lavialle, C., et al. (2013) "Paleovirology of 'syncytins', retroviral env genes exapted for a role in placentation" Philosophical transactions of the Royal Society of London. 368(1626), 20120507
[51] Wikipedia contributors (2021) "Evolutionary developmental biology" Wikipedia
[52] Rebollo R, et al. (2012) "Transposable elements: an abundant and natural source of regulatory sequences for host genes" Annual Review of Genetics 46 (1): 21 - 42
[53] См. главу: "Происхождение и распространённость вирусов".
[54] Harrison, RL et al. (2018). "ICTV Virus Taxonomy Profile: Baculoviridae". The Journal of General Virology. 99 (9): 1185 - 1186
[55] Wang, M., & Hu, Z. (2019) "Cross-talking between baculoviruses and host insects towards a successful infection" Philosophical transactions of the Royal Society of London. 374(1767), 20180324
[56] Theze, J. et al. (2011) "Paleozoic origin of insect large dsDNA viruses". PNAS. 108 (38): 15931 - 5
[57] Young, G. R., et al. (2012) "Resurrection of endogenous retroviruses in antibody-deficient mice". Nature, 491(7426), 774 - 778
[58] Agrawal, A., et al (1998) "Transposition mediated by RAG1 and RAG2 and its implications for the evolution of the immune system" Nature 394, 744 - 751
[59] Young, G. R. et al. (2012) "Resurrection of endogenous retroviruses in antibody-deficient mice" Nature, 491(7426), 774 - 778
[60] Volff, JN. (2005) "Genome evolution and biodiversity in teleost fish" Heredity 94, 280 - 294
[61] Capinera, John L. (2008) "Butterflies and moths" In "Encyclopedia of Entomology". Springer. pp. 626 - 672
[62] Mallet, Jim (2007) "Taxonomy of Lepidoptera: the scale of the problem". The Lepidoptera Taxome Project
[63] van Eldijk et al. (2018) "A Triassic-Jurassic window into the evolution of Lepidoptera". Science Advances. 4 (1): e1701568
[64] J.-C. Sohn et al. (2015) "The fossil record and taphonomy of butterflies and moths (Insecta, Lepidoptera): Implications for evolutionary diversity and divergence-time estimates" BMC Evol. Biol. 15, 12
[65] Jennifer Welsh (2011) "Oldest Viruses Infected Insects 300 Million Years Ago" Live Science
[66] Gasmi L, et al. (2015) "Recurrent Domestication by Lepidoptera of Genes from Their Parasites Mediated by Bracoviruses" PLOS Genetics 11(9): e1005470







Комментарий: Читайте все опубликованные статьи в рубрике Массовые вымирания, эволюционные скачки и связь вирусов с информацией.