Люди начали использовать самый первый антибиотик пенициллин более 40 тысяч лет назад, а в XX веке перешли от его природных форм к массовому производству, что официально запустило страшную гонку на выживание между царством бактерий и животных. С каждым новым поколением антибактериальных препаратов сокращается число смертей среди зараженных, в то же время появляется новый штамм побежденного возбудителя — тот становится резистентнее, сильнее и неприхотливее, чем когда-либо прежде.
Некоторые бактерии пытаются адаптироваться под сосуществование с человеком, чтобы не разрушать его организм, а наоборот, помогать: к примеру, переваривать определенные продукты, как это делают бифидобактерии. Но немало бактерий, которые «недальновидны» и уничтожают организм буквально за несколько дней, обрекая на гибель собственные будущие поколения.
К таким можно отнести синегнойную палочку (Pseudomonas aeruginosa). Она особенно опасна для людей с ослабленной иммунной системой и «любит» пациентов с ожогами или хирургическими ранами, а также больных муковисцидозом.
Хуже того, под влиянием прогресса в медицине синегнойная палочка со временем выработала высокую резистентность к существующим антибиотикам, что затрудняет ее лечение в случае заражения. В частности, она научилась вырабатывать сигнальные молекулы, благодаря которым целые колонии патогена могут принимать общие решения для приспособления к особенностям среды и собственной защиты.
Они формируют особую биопленку, защищающую целую колонию от попадания в нее вредных веществ, в том числе антибактериальных препаратов. Однако исследователям из Северо-Западного университета (США) удалось найти окольный путь к уничтожению смертельного патогена.
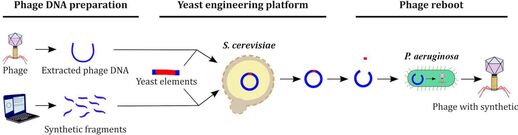
В новом исследовании, опубликованном в журнале Microbiology Spectrum, ученые модифицировали ДНК бактериофага, способного заражать бактерии и размножаться внутри них. Сначала выделили ДНК нескольких фагов, а затем применили электропорацию — короткие высоковольтные импульсы электричества, — чтобы проделать временные отверстия во внешней клетке бактерии. Через эти отверстия ДНК фага просочилась в бактерии, имитируя процесс заражения.
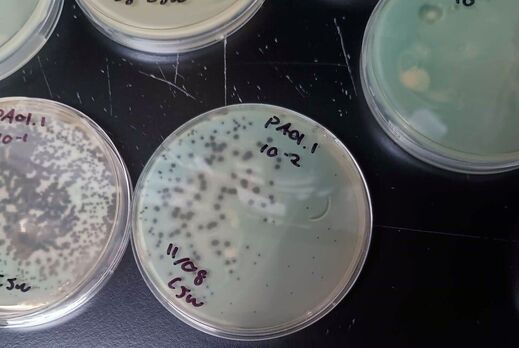
После этого успеха команда, возглавляемая Эрикой Хартманн, ввела ДНК еще двух фагов, которые по своей природе не способны заразить штамм Pseudomonas aeruginosa. И снова процесс сработал.
Теперь команда изучает фаги, выделенные из уничтоженной синегнойной палочки. Так они решат, какие из получившихся штаммов развивать и как в итоге их массово производить в качестве терапевтического средства.
«Что особенного в фаге, так это то, что он может быть очень специфичным, в отличие от антибиотиков. Например, если вы принимаете антибиотик при инфекции носовых пазух, он разрушает весь желудочно-кишечный тракт. Фаготерапия же может быть разработана так, чтобы воздействовать исключительно на целевую инфекцию», — сказала Хартманн.Таким образом, фаготерапия не только демонстрирует большую перспективность в лечении устойчивых инфекций, но и предлагает альтернативную терапию, после которой не придется страдать от расстройств желудочно-кишечного тракта, восстанавливаясь пробиотиками.





Комментарий: Читайте также: